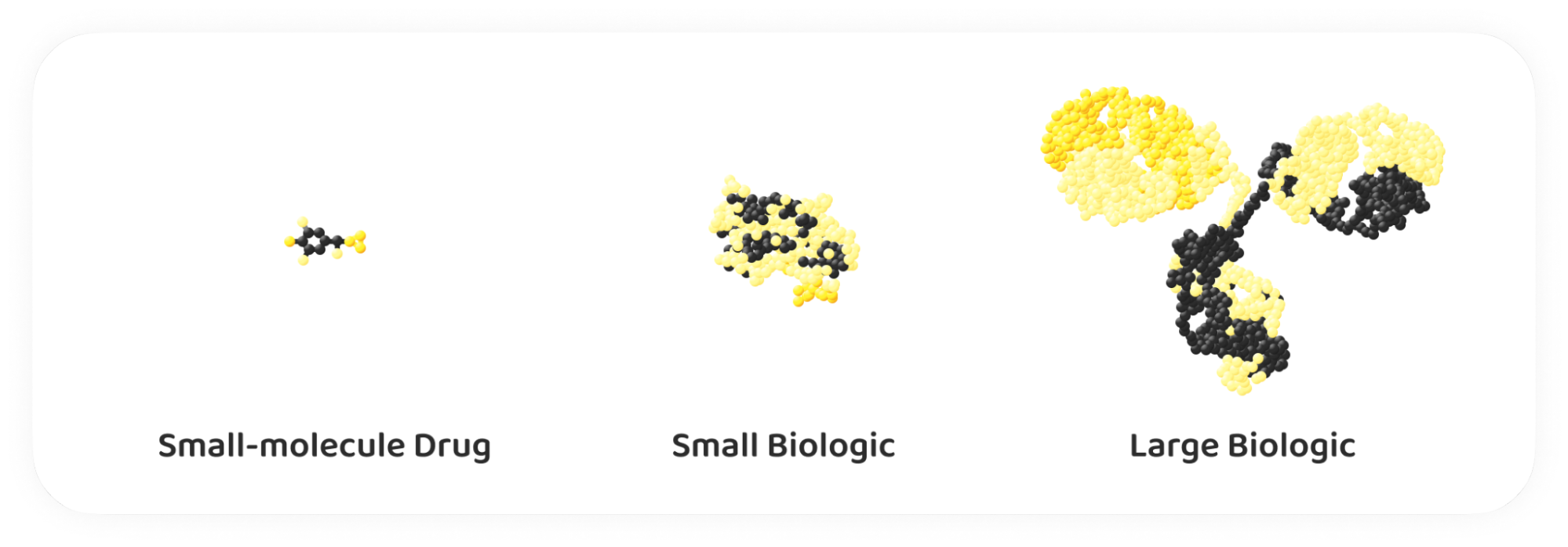
Ein Blick auf die offizielle Definition zeigt, dass es sich bei Biosimilars um biologische Medizinprodukte handelt, die einem bereits zugelassenen biologischen Produkt (dem so genannten Referenzprodukt oder Originalpräparat) sehr ähnlich sind und keine klinisch bedeutsamen Unterschiede aufweisen.
Diese Definition verdeutlicht das Kernkonzept der Biosimilarität: Obwohl eine perfekte Replikation aufgrund der natürlichen Variabilität lebender Zellen nicht möglich ist, müssen Biosimilars ihren Referenzprodukten in der klinischen Leistung entsprechen. Sie enthalten die gleichen Wirkstoffe wie die ursprünglichen biologischen Arzneimittel und werden erst nach Ablauf des Patents des Originalpräparats auf den Markt gebracht.
Um ein Biosimilar zu entwickeln, muss man die molekularen Eigenschaften, die biologische Aktivität und das klinische Profil des Referenzprodukts genau kennen. Es muss nachgewiesen werden, dass das Biosimilar mit dem Referenzprodukt „vergleichbar“ ist, und zwar durch umfangreiche analytische, nicht-klinische und klinische Studien, auf die wir später noch näher eingehen werden.
Biosimilars vs. Generika
Wenn Sie schon einmal von biologischen Arzneimitteln gehört haben, haben Sie wahrscheinlich auch schon von Generika gehört. Generika sind identische Kopien von Markenarzneimitteln, haben aber einen anderen Namen und werden in der Regel zu einem niedrigeren Preis angeboten. Sie wirken auf die gleiche Weise und enthalten die gleichen Wirkstoffe, werden aber von anderen Herstellern produziert. Mit anderen Worten: Ein Generikum ist ein identischer Ersatz für sein Markenmedikament.
Was unterscheidet Biosimilars also von Generika und ihren biologischen Referenzpräparaten? Im Gegensatz zu Generika sind Biosimilars aufgrund der Komplexität der biologischen Produktion keine exakten Kopien ihrer biologischen Referenzpräparate.

Bevor wir uns den wichtigsten Unterscheidungsmerkmalen zuwenden, werfen wir einen Blick auf einen detaillierten Vergleich, der die Anforderungen und Prozesse für Originalpräparate, Biosimilars und Generika veranschaulicht.
Aus dieser Tabelle geht hervor, dass Biosimilars einen strengen Bewertungsprozess durchlaufen, der sich viel stärker an den Referenzbiologika orientiert als bei den Generika. Dies macht die Entwicklung und Zulassung von Biosimilars komplexer und sorgfältiger als die von Generika.
Auf dieser Grundlagen, wollen wir nun einen genaueren Blick auf drei wesentliche Merkmale werfen, in denen sich Biosimilars und Generika unterscheiden:
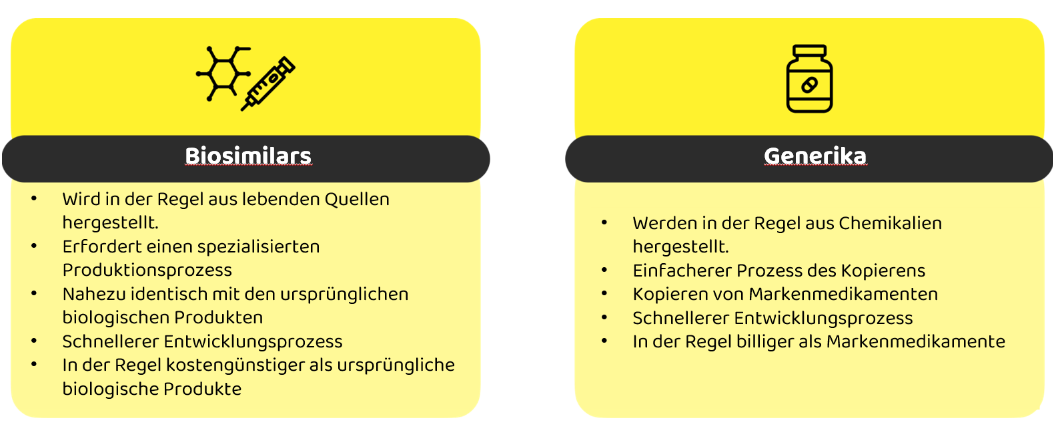
Herstellungsprozess
Generika werden durch einen chemischen Syntheseprozess hergestellt, der eine konsistente und identische Replikation der Wirkstoffe des Originalmedikaments ermöglicht. Bei der biologischen Herstellung hingegen laufen komplexe biochemische Prozesse in lebenden Zellen ab, die empfindlich auf geringfügige Änderungen der Herstellungsbedingungen reagieren.
Zu diesen Bedingungen gehören Schwankungen der Temperatur, des pH-Werts, der Nährstoffe im Wachstumsmedium und sogar geringfügige Abweichungen bei der Handhabung. Jeder dieser Faktoren kann beeinflussen, wie die Zellen wachsen und die biologischen Moleküle produzieren.
Darüber hinaus kann auch der Reinigungsprozess, mit dem die aktiven biologischen Substanzen von den Wirtszellen und anderen Nebenprodukten isoliert werden sollen, zu Abweichungen führen. Da lebende Organismen beteiligt sind, ist es schwierig, die exakte biologische Umgebung und die Prozesse von Charge zu Charge zu reproduzieren, was zu Schwankungen im Endprodukt führt.
Diese natürliche Variabilität ist der Grund, warum Biosimilars keine exakten Kopien ihrer Referenzbiologika sein können und warum strenge Tests und Vergleiche notwendig sind, um sicherzustellen, dass sie dieselben Standards erfüllen.
Source: https://www.nationalmssociety.org/Treating-MS/Medications/Generic-and-Biosimilar-Medications
Genehmigungsverfahren
Das Zulassungsverfahren für Generika ist relativ unkompliziert und erfordert im Allgemeinen nur Bioäquivalenzstudien. Mit diesen Studien soll nachgewiesen werden, dass das Generikum dieselben Wirkstoffe enthält und auf dieselbe Weise wirkt wie das Markenarzneimittel. Dabei geht es vor allem darum, sicherzustellen, dass das Arzneimittel eine ähnliche Konzentration im Blutkreislauf mit ähnlicher Geschwindigkeit erreicht wie das Original.
Biosimilars durchlaufen jedoch ein strenges Zulassungsverfahren, das viele der für die Originalpräparate erforderlichen Schritte widerspiegelt. Dazu gehören umfangreiche Qualitätsbewertungen und sowohl nicht-klinische als auch klinische Studien. Zu den nicht-klinischen Bewertungen gehören In-vitro- und, falls erforderlich, In-vivo-Studien zur Beurteilung der biologischen Aktivität. Klinische Studien für Biosimilars konzentrieren sich auf die Pharmakokinetik und Pharmakodynamik, ähnlich wie beim Originalpräparat, erfordern aber in der Regel keine Phase-II-Studien.
Sowohl das Originalpräparat als auch das Biosimilar müssen klinische Wirksamkeits- und Sicherheitsstudien der Phase III durchlaufen, um die therapeutische Gleichwertigkeit und Sicherheit zu gewährleisten. Darüber hinaus unterliegen beide einer laufenden Pharmakovigilanz zur Überwachung der Sicherheit und Wirksamkeit nach der Zulassung.
Austauschbarkeit
In der Schweiz ist die Substitution von Biologika durch Biosimilars anders geregelt als bei Generika, da die Austauschbarkeit von Biosimilars mit Referenzbiologika etwas komplexer ist.
Ab Januar 2024 wurde die Schweizer Gesetzgebung dahingehend geändert, dass Apotheker Biologika unter bestimmten, im Krankenversicherungsgesetz festgelegten Bedingungen durch Biosimilars mit demselben Wirkstoff ersetzen dürfen. Dies stellt eine bedeutende Veränderung dar, denn bisher konnten nur verschreibende Ärzte solche Substitutionen auf der Grundlage einer detaillierten Bewertung der individuellen Patientenbedürfnisse und der therapeutischen Äquivalenz des Biosimilars veranlassen.
Trotz dieser gesetzlichen Erlaubnis zur Substitution durch den Apotheker ist es jedoch wichtig, dass sowohl Apotheker als auch verordnende Ärzte die Reaktionen der Patienten genau beobachten und mögliche Risiken oder Vorteile berücksichtigen.
Diese sorgfältige Abwägung ist unerlässlich, da selbst geringfügige Abweichungen im Herstellungsprozess von Biosimilars das Ergebnis für den Patienten beeinflussen können. Auch wenn Apothekerinnen und Apotheker nun befugt sind, diese Substitutionen vorzunehmen, unterstreicht der übergreifende Leitfaden von Swissmedic die Notwendigkeit einer patientenspezifischen Beurteilung der Austauschbarkeit von Biosimilars.
Die Rolle der Biosimilars in der modernen Medizin
Das Aufkommen von Biosimilars verändert nicht nur die individuelle Patientenversorgung, sondern die gesamte Gesundheitslandschaft. In der Schweiz hat die Integration von Generika und Biosimilars zu beträchtlichen Kosteneinsparungen geführt und eine Reihe gesetzlicher und politischer Anpassungen veranlasst, die darauf abzielen, deren Einsatz weiter zu fördern.
Die Integration von Generika und Biosimilars hat zu Einsparungen von rund 679 Millionen CHF im Jahr 2023 geführt. Dennoch ist die Akzeptanz von Biosimilars noch nicht so weit verbreitet wie erwartet. Gemäss dem jüngsten Biosimilar-Barometer hat die Schweiz trotz der verfügbaren Biosimilars ein Einsparungspotenzial von 90 Millionen CHF im Jahr 2023 verpasst. Diese verpasste Chance ist auf die anhaltende Präferenz für teurere Originalbiologika zurückzuführen, die immer noch die Hälfte aller Fälle ausmachten, in denen billigere Biosimilar-Alternativen verfügbar waren.
In Anerkennung der Notwendigkeit, die Einführung von Biosimilars zu fördern, haben die Schweizer Behörden mehrere Maßnahmen ergriffen, die ab 2024 gelten sollen. Dazu gehören, wie bereits erwähnt, die Erlaubnis für Apotheker, Original-Biologika durch Biosimilars zu ersetzen, die Anwendung differenzierter Selbstbehalte, um Patienten zu ermutigen, sich für Biosimilars zu entscheiden, die Sicherstellung von Kostengutsprachen sowohl für Biologika als auch für deren Biosimilars und die Überarbeitung der Vertriebsmargen für Arzneimittel, um finanzielle Fehlanreize für die Verschreibung von Biosimilars zu beseitigen.
Neben der Senkung der Gesundheitskosten verbessern Biosimilars den Zugang der Patienten zu notwendigen biologischen Behandlungen, indem sie finanzielle Barrieren abbauen. In der Schweiz wird der Marktanteil von Biosimilars im Jahr 2023 volumenmässig rund 56% erreichen, wobei einzelne Biosimilars wie Bevacizumab einen Marktanteil von bis zu 69% erreichen. Es wird erwartet, dass diese verbesserte Zugänglichkeit weiter zunehmen wird, da weitere Patente für Biologika auslaufen und neue Biosimilars auf den Markt kommen, was eine Zukunft verspricht, in der die Gesundheitssysteme die hohen Kosten, die mit biologischen Medikamenten verbunden sind, nachhaltig verwalten können.
Darüber hinaus fördert der durch Biosimilars ausgelöste Wettbewerb nicht nur die Innovation innerhalb der biopharmazeutischen Industrie, sondern führt auch zu Fortschritten bei den Herstellungsverfahren und der Technologie. Diese zyklische Dynamik sorgt für eine kontinuierliche Entwicklung von biologischen Arzneimitteln und verbessert die Ergebnisse und die Effizienz auf der ganzen Linie.
Erweiterung der Behandlungsmöglichkeiten durch Biosimilars
Biosimilars werden in verschiedenen medizinischen Fachbereichen zur Behandlung chronischer und schwerwiegender Erkrankungen eingesetzt und spiegeln die vielfältigen Anwendungsmöglichkeiten ihrer Referenzbiologika wider. Während die Besonderheiten jedes Biosimilars von den zugelassenen Indikationen abhängen, sind diese Behandlungen häufig in folgenden Bereichen zu finden:
⦁ Rheumatologie
⦁ Gastroenterologie
⦁ Dermatologie
⦁ Ophthalmologie
⦁ Onkologie
In der Rheumatologie werden Biosimilars zur Behandlung von Erkrankungen wie rheumatoider Arthritis eingesetzt, wo sie helfen, Entzündungen zu reduzieren und das Fortschreiten der Krankheit zu verlangsamen. In ähnlicher Weise werden sie in der Gastroenterologie zur Behandlung chronischer Darmerkrankungen wie Morbus Crohn und Colitis ulcerosa eingesetzt, um den Patienten Linderung zu verschaffen und ihre Lebensqualität zu erhalten.
Dermatologen verwenden Biosimilars zur Behandlung chronischer Hautkrankheiten wie Schuppenflechte, indem sie die Immunreaktion modulieren, um die Symptome zu lindern und Krankheitsschübe zu verhindern. In der Augenheilkunde helfen Biosimilars bei der Behandlung von Krankheiten wie der altersbedingten Makuladegeneration, indem sie wichtige Behandlungen bereitstellen, die das Sehvermögen erhalten und schwere Sehstörungen verhindern.
In der Onkologie spielen Biosimilars eine entscheidende Rolle, da sie die Verfügbarkeit von monoklonalen Antikörpern erhöhen, die zur Bekämpfung und Neutralisierung von Krebszellen eingesetzt werden. Diese Anwendung ist von entscheidender Bedeutung für die Verbesserung der Patientenergebnisse bei der Behandlung verschiedener Krebsarten, einschließlich Brust-, Darm- und nicht-kleinzelligem Lungenkarzinom.
Zulassungsprozess und Sicherheit von Biosimilars
In der Schweiz wird die Zulassung von Biosimilars vom Schweizerischen Heilmittelinstitut (Swissmedic) verwaltet, das seine eigenen strengen Standards entwickelt hat, die sich zwar an der weltweiten Praxis orientieren, aber auf die spezifischen Bedürfnisse des Gesundheitswesens und die Sicherheitsstandards des Landes zugeschnitten sind.
Das Zulassungsverfahren für ein Biosimilar in der Schweiz beginnt mit einer umfassenden analytischen Beurteilung. In dieser ersten Phase werden die molekularen und biologischen Eigenschaften des Biosimilars detailliert mit denen des biologischen Referenzpräparats verglichen. Die Bewertung konzentriert sich auf eine Reihe von Merkmalen, darunter Aminosäuresequenzen, posttranslationale Modifikationen wie Glykosylierungsmuster und Strukturen höherer Ordnung.
Nach der analytischen Bewertung wird das Biosimilar präklinischen Tests unterzogen, um seine Toxizität, Pharmakokinetik (wie das Medikament im Körper absorbiert, verteilt, metabolisiert und ausgeschieden wird) und Pharmakodynamik (die biologischen Auswirkungen des Medikaments auf den Körper) zu bewerten. Diese Studien sind von entscheidender Bedeutung, um mögliche biologische Auswirkungen zu ermitteln, bevor klinische Versuche durchgeführt werden.
Die klinischen Versuche für Biosimilars in der Schweiz sind umfassend und umfassen die Pharmakokinetik und Pharmakodynamik sowie die Immunogenität und das Sicherheitsprofil. Diese Versuche sollen bestätigen, dass es keine klinisch bedeutsamen Unterschiede zwischen dem Biosimilar und seinem Referenzprodukt in Bezug auf Sicherheit, Wirksamkeit und immunogenes Ansprechen gibt.
Darüber hinaus schreibt Swissmedic eine laufende Überwachung nach der Markteinführung vor, um die langfristige Sicherheit und Wirksamkeit von Biosimilars zu überwachen. Durch diese Überwachung werden unerwünschte Wirkungen aufgedeckt, die in den Studien vor der Zulassung nicht erkennbar waren, und es wird sichergestellt, dass potenzielle Risiken umgehend und wirksam behandelt werden.
Die Zukunft der Biosimilars mit iQone Healthcare
Es wird erwartet, dass der Markt für Biosimilars ein beträchtliches Wachstum verzeichnen wird, da in den nächsten Jahren die Patente für mehrere führende Biologika auslaufen werden. Dies wird den Weg für den Markteintritt neuer Biosimilars ebnen, den Wettbewerb verstärken und die Kosten für biologische Behandlungen weiter senken.
Darüber hinaus verbessern Fortschritte in der Biotechnologie die Effizienz und Präzision der Entwicklung von Biosimilars, was zu noch robusteren und wirksameren Produkten führt. Dies könnte den Anwendungsbereich von Biosimilars über die bloße Nachahmung bestehender Biologika-Therapien hinaus erweitern und Möglichkeiten für neuartige Behandlungen eröffnen.
Die zunehmende Sensibilisierung und Aufklärung von medizinischem Fachpersonal und Patienten über Biosimilars wird ebenfalls eine wichtige Rolle bei der Gestaltung der Zukunft dieses Marktes spielen. Je mehr Akteure mit diesen Produkten und ihren potenziellen Vorteilen vertraut werden, desto mehr Akzeptanz und Einsatz ist von Biosimilars in den Gesundheitsystemen weltweit zu erwarten.
Wir bei iQone Healthcare Switzerland sind davon überzeugt, dass Innovation, harte Arbeit und Einsatz das Leben der Menschen um uns herum verbessern können. Unter dem Motto „iQone for you“ konzentrieren wir uns auf die Bereitstellung von qualitativ hochwertigen Biosimilars und innovativen Medikamenten, die speziell auf die Bedürfnisse des Schweizer Marktes abgestimmt sind. Als unabhängiges Spezialitätenpharmaunternehmen ist es unsere Hauptaufgabe, dafür zu sorgen, dass therapeutische Fortschritte wie Biosimilars und bahnbrechende Medikamente die Patienten erreichen, die sie brauchen, und zwar dann, wenn sie sie brauchen.
Mit einem der umfangreichsten Biosimilar-Portfolios in der Schweiz diversifizieren wir kontinuierlich mit innovativen neuen Medikamenten, die jeweils für eine Reihe von Krankheitszuständen entwickelt wurden. Unser Ziel ist es, ein differenziertes und ganzheitliches Angebot an therapeutischen Optionen für eine Vielzahl von Krankheitszuständen bereitzustellen. Damit wollen wir unser Engagement für eine bessere Patientenversorgung und bessere Behandlungsergebnisse unter Beweis stellen und gleichzeitig unsere Unterstützung für die Angehörigen der Gesundheitsberufe und das Schweizer Gesundheitssystem hervorheben.
Um mehr über unser Biosimilar-Portfolio und neue Produktentwicklungen zu erfahren, besuchen Sie bitte unsere Website und zögern Sie nicht, uns für weitere Informationen zu kontaktieren
Biosimilars FAQs
Was ist der Unterschied zwischen einem Biosimilar und einem Originalpräparat?
Ein Original-Biologikum ist ein komplexes Produkt, das durch biotechnologische Prozesse in lebenden Zellen erzeugt wird. Ein Biosimilar ähnelt dem biologischen Originalpräparat, kommt aber erst auf den Markt, wenn das Referenzprodukt nicht mehr durch ein Patent geschützt ist. Ein Biosimilar ist dem Original in Bezug auf Wirksamkeit, Sicherheit und Qualität sowie im klinischen Sinne „ähnlich“; allerdings können sehr geringe Abweichungen auftreten, da Biosimilars von lebenden Systemen (Zellen) hergestellt werden.
Sind Biosimilars mit den Original-Biologika identisch?
Biosimilars sind aufgrund der inhärenten Komplexität und der natürlichen Schwankungen im biologischen Produktionsprozess nicht mit den Original-Biologika identisch. Jedes biologische Präparat, einschließlich Biosimilars, wird in lebenden Zellen hergestellt, was zu leichten Abweichungen in den biologischen Molekülen führen kann. Biosimilars ähneln ihren ursprünglichen Biologika.
Wie wirksam ist ein Biosimilar im Vergleich zum Referenzprodukt?
Sie sind gleich wirksam, wie wiederholte klinische Studien gezeigt haben und wie von Swissmedic zertifiziert. Aufgrund ihres biologischen Ursprungs können Biosimilars von einer Produktionsserie zur nächsten leicht variieren. Die Abweichungen halten sich jedoch in sehr genauen Grenzen und beeinflussen in keiner Weise die Sicherheit, Wirksamkeit und Qualität der Produkte.
Sind Biosimilars sicher?
Ja, Biosimilars werden genauso gut vertragen wie das Referenzprodukt.
Sie werden strengen Tests unterzogen und müssen strenge regulatorische Standards für Sicherheit, Wirksamkeit und Qualität erfüllen, ähnlich wie die ursprünglichen biologischen Arzneimittel, bevor sie zugelassen werden.
Gibt es einen Preisunterschied zwischen einem Biosimilar und dem Original? Wird das Biosimilar von den Krankenkassen erstattet?
Gemäss dem Bundesamt für Gesundheit (BAG) müssen Biosimilars zum Zeitpunkt der Markteinführung mindestens 20 bis 35% weniger kosten als ihre Referenzprodukte (mit einigen Ausnahmen). Biosimilars werden von den Krankenkassen erstattet gemäss jeweiligem Status der Kassenzulässigkeit.
Wo finde ich zusätzliche und detaillierte Informationen über Ihre Biosimilar-Produkte und deren Verwendung?
Für weitere Informationen zu unseren Produkten können Sie uns gerne kontaktieren oder die Swissmedic Website besuchen.

