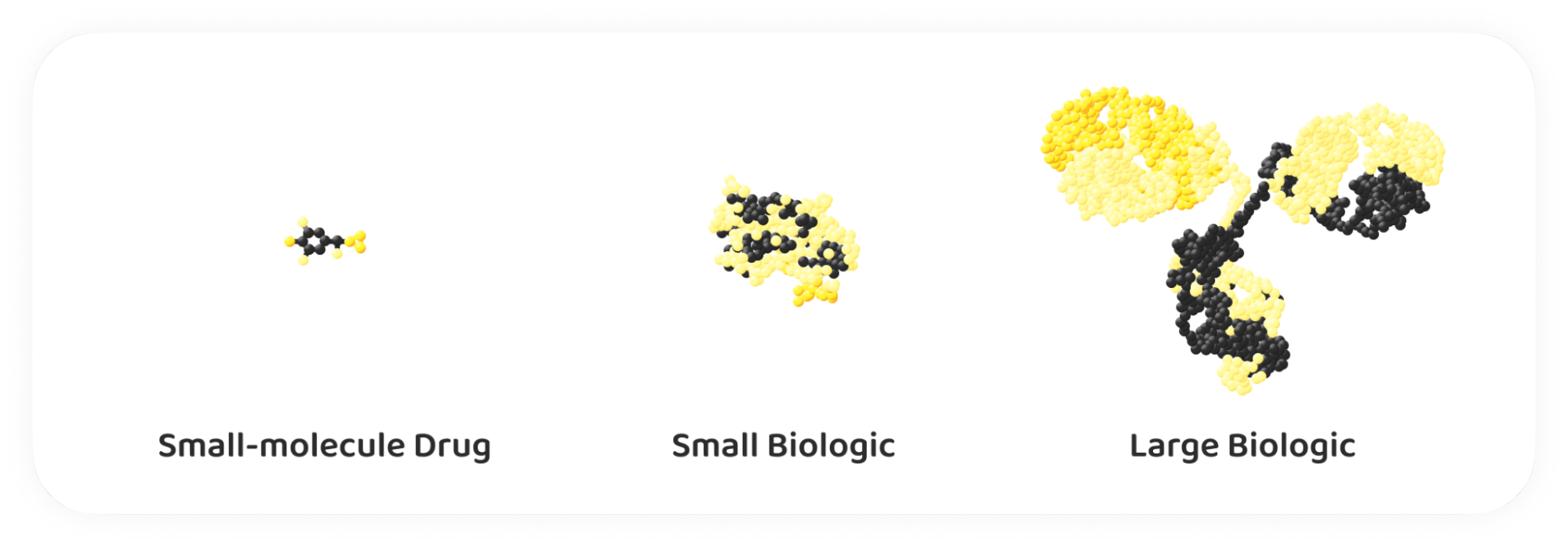
Si l'on examine la définition officielle, on constate que les biosimilaires sont définis comme des produits médicaux biologiques très similaires à un produit biologique déjà approuvé (connu sous le nom de produit de référence ou produit d'origine), sans différence cliniquement significative.
Cette définition met en évidence le concept central de la biosimilarité : même si une réplication parfaite est impossible en raison de la variabilité naturelle des cellules vivantes, les biosimilaires doivent avoir des performances cliniques équivalentes à celles de leurs produits de référence. Ils contiennent les mêmes ingrédients actifs que les médicaments biologiques originaux et ne sont mis sur le marché qu'après l'expiration du brevet du médicament original.
Pour développer un biosimilaire, il faut avoir une connaissance approfondie des caractéristiques moléculaires, de l'activité biologique et du profil clinique du produit de référence. Vous devez démontrer que le biosimilaire est « comparable » à son produit de référence par le biais d'études analytiques, pré-cliniques et cliniques approfondies, que nous aborderons plus en détail ultérieurement.
Biosimilaires et médicaments génériques
Si vous avez entendu parler des médicaments biologiques, vous avez probablement aussi entendu parler des médicaments génériques. Les médicaments génériques sont des copies identiques des médicaments de marque, mais portent un nom différent et sont généralement proposés à un prix inférieur. Ils agissent de la même manière et contiennent les mêmes principes actifs, mais sont produits par des fabricants différents. En d'autres termes, un médicament générique est un substitut identique à son homologue de marque.
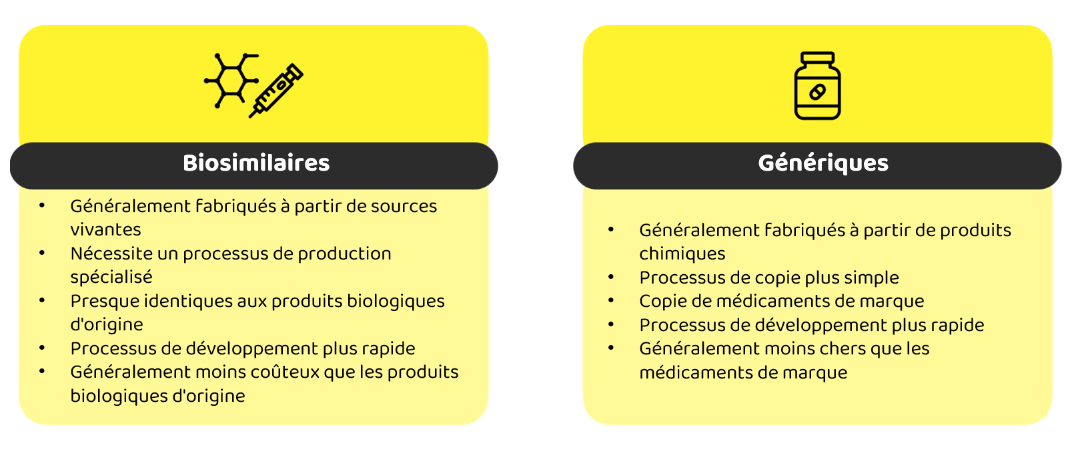
Qu'est-ce qui différencie les biosimilaires des médicaments génériques et de leurs produits biologiques de référence ? Contrairement aux versions génériques, les biosimilaires ne sont pas des copies exactes des médicaments biologiques de référence en raison des complexités inhérentes à la production biologique.
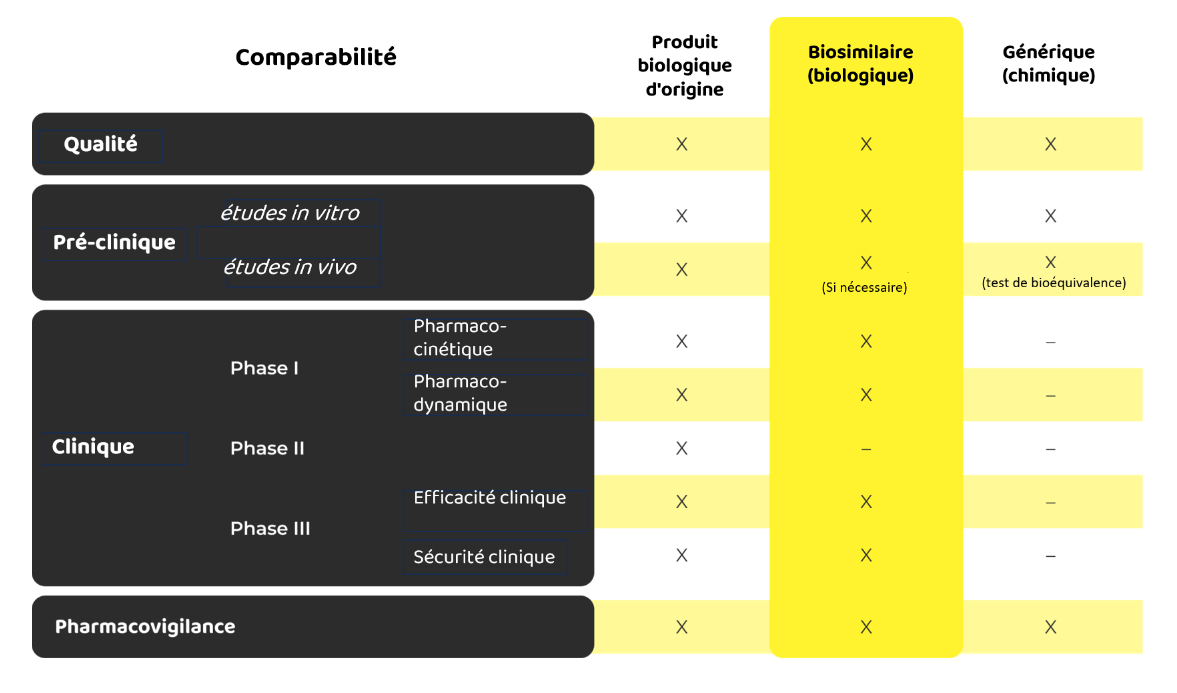
Avant d'aborder les principales caractéristiques qui les différencient, nous vous proposons une comparaison détaillée illustrant les exigences et les procédures applicables aux produits biologiques d'origine, aux produits biosimilaires et aux médicaments génériques.
Ce tableau montre clairement que les biosimilaires sont soumis à un processus d'évaluation rigoureux qui reflète le produit biologique de référence beaucoup plus étroitement que les génériques ne le font avec leurs homologues. Le développement et l'approbation des biosimilaires sont donc plus complexes et plus minutieux que ceux des médicaments génériques.
Maintenant que ces bases sont posées, examinons plus en détail trois caractéristiques clés qui différencient les biosimilaires des médicaments génériques :
Processus de fabrication
Les médicaments génériques sont fabriqués par un processus de synthèse chimique, qui permet de reproduire de manière cohérente et identique les principes actifs du médicament original. D'autre part, la nature inhérente à la production biologique implique des processus biochimiques complexes au sein de cellules vivantes, qui sont sensibles à de légers changements dans les conditions de fabrication.
Ces conditions comprennent des variations de température, de pH, de nutriments dans le milieu de croissance et même des écarts mineurs dans les techniques de manipulation. Chacun de ces facteurs peut influencer la façon dont les cellules se développent et produisent les molécules biologiques.
En outre, le processus de purification, conçu pour isoler les substances biologiques actives des cellules hôtes et d'autres sous-produits, peut également introduire des variations. Comme il s'agit d'organismes vivants, il est difficile de reproduire l'environnement et les processus biologiques exacts d'un lot à l'autre, ce qui entraîne une variabilité du produit final.
Cette variabilité naturelle explique pourquoi les biosimilaires ne peuvent pas être des copies exactes de leurs produits biologiques de référence et pourquoi des tests et des comparaisons rigoureux sont nécessaires pour s'assurer qu'ils répondent aux mêmes normes.
Source: https://www.nationalmssociety.org/Treating-MS/Medications/Generic-and-Biosimilar-Medications
Processus d'approbation
Le processus d'approbation des médicaments génériques est relativement simple et ne nécessite généralement que des études de bioéquivalence. Ces études sont conçues pour prouver que le médicament générique contient les mêmes ingrédients actifs et agit de la même manière que le médicament d'origine, en veillant principalement à ce que le médicament atteigne une concentration similaire dans la circulation sanguine et à une vitesse similaire à celle du médicament d'origine.
Les biosimilaires sont toutefois soumis à un processus d'approbation rigoureux qui reflète un grand nombre des étapes requises pour les produits biologiques d'origine. Ce processus comprend des évaluations approfondies de la qualité et des études cliniques et pré-cliniques. Les évaluations pré-cliniques comprennent des études in vitro et, si nécessaire, in vivo pour évaluer l'activité biologique. Les études cliniques pour les biosimilaires se concentrent sur la pharmacocinétique et la pharmacodynamique, comme pour le produit d'origine, mais ne nécessitent généralement pas d'essais de phase II.
Le produit d'origine et le biosimilaire doivent tous deux faire l'objet d'essais cliniques d'efficacité et de sécurité de phase III afin de garantir l'équivalence thérapeutique et la sécurité. En outre, tous deux sont soumis à une pharmacovigilance continue pour contrôler la sécurité et l'efficacité après l'approbation.
Interchangeabilité
En Suisse, la substitution des produits biologiques par des biosimilaires présente une approche réglementaire différente de celle des médicaments génériques, car l'interchangeabilité des biosimilaires avec les produits biologiques de référence est un peu plus complexe.
À partir de janvier 2024, la législation suisse a été révisée pour permettre aux pharmaciens de remplacer des produits biologiques par des biosimilaires contenant le même principe actif, dans des conditions spécifiques décrites dans la loi sur l'assurance maladie. Il s'agit d'un changement important, car auparavant, seuls les médecins prescripteurs pouvaient procéder à de telles substitutions sur la base d'une évaluation détaillée des besoins individuels des patients et de l'équivalence thérapeutique du biosimilaire.
Cependant, malgré cette autorisation légale de substitution par le pharmacien, il est important que les pharmaciens et les prestataires de soins de santé prescripteurs surveillent de près les réactions des patients et prennent en compte les risques et les avantages potentiels.
Le rôle des biosimilaires dans la médecine moderne
L'émergence des biosimilaires est en train de refaçonner non seulement la prise en charge individuelle des patients, mais aussi l'ensemble du paysage de la santé. En Suisse, l'intégration des génériques et des biosimilaires a permis de réaliser des économies substantielles et a donné lieu à une série d'ajustements législatifs et politiques visant à stimuler leur utilisation.L'intégration des génériques et des biosimilaires a permis de réaliser des économies d'environ 679 millions de francs suisses en 2023. Néanmoins, l'adoption des biosimilaires n'est pas encore aussi répandue que prévu. Selon le récent rapport du baromètre des biosimilaires les 90 millions economies de francs suisses potentielles en 2023 n'ont pas pu être réalisées.
Cela est due à la préférence persistante pour les médicaments biologiques originaux plus coûteux, qui représentent encore la moitié de tous les cas où des alternatives biosimilaires moins chères étaient disponibles.
Reconnaissant la nécessité d'améliorer l'adoption des biosimilaires, les autorités suisses ont mis en œuvre plusieurs mesures qui entreront en vigueur à partir de 2024. Il s'agit notamment, comme nous l'avons déjà mentionné, de permettre aux pharmaciens de remplacer les produits biologiques originaux par des biosimilaires, d'appliquer des franchises différenciées pour encourager les patients à opter pour les biosimilaires, de veiller à ce que les crédits de coûts couvrent à la fois les produits biologiques et leurs biosimilaires, et de réviser les marges de distribution des médicaments afin d'éliminer les mesures financières dissuasives pour la prescription de biosimilaires.
Au-delà de la réduction des coûts de santé, les biosimilaires améliorent l'accès des patients aux traitements biologiques en éliminant les barrières financières. En Suisse, la part de marché des biosimilaires a atteint environ 56 % en volume en 2023.
Certains de ces biosimilaires, comme le Bevacizumab ont atteint jusqu'à 69 % de part de marché. Cette accessibilité accrue devrait continuer à croître à mesure que d'autres brevets biologiques expirent et que de nouveaux biosimilaires arrivent sur le marché, ce qui promet un avenir où les systèmes de santé pourront gérer durablement les coûts élevés associés aux médicaments biologiques.
En outre, la concurrence suscitée par les biosimilaires favorise non seulement l'innovation au sein de l'industrie biopharmaceutique, mais conduit également à des avancées dans les processus de fabrication et la technologie. Cette dynamique cyclique garantit le développement continu des médicaments biologiques, améliorant ainsi les résultats et l'efficacité dans tous les domaines.
En fin de compte, l'intégration stratégique des biosimilaires dans la pratique clinique et la politique de santé reflète un changement significatif vers des systèmes de santé plus durables en Suisse et à l’étranger. Cette évolution est soutenue par un suivi complet et des contrôles d'efficacité, tels que ceux facilités par le baromètre des biosimilaires, qui garantissent que les politiques adoptées pour promouvoir les biosimilaires atteignent les objectifs visés.
Élargir les options thérapeutiques grâce aux biosimilaires
Les biosimilaires sont utilisés dans diverses spécialités médicales pour traiter des maladies chroniques et graves, reflétant ainsi les diverses applications de leurs produits biologiques de référence. Bien que les spécificités de chaque biosimilaire dépendent de ses indications approuvées, ces traitements sont couramment utilisés dans les domaines suivants:
⦁ Rhumatologie
⦁ Gastro-entérologie
⦁ Dermatologie
⦁ Ophthalmologie
⦁ Oncologie
En rhumatologie, les biosimilaires sont utilisés pour traiter des maladies telles que la polyarthrite rhumatoïde, où ils contribuent à réduire l'inflammation et à ralentir la progression de la maladie. Ils sont également utilisés en gastro-entérologie pour traiter des maladies intestinales chroniques telles que la maladie de Crohn et la colite ulcéreuse, afin de soulager les patients et de préserver leur qualité de vie.
Les dermatologues utilisent les biosimilaires pour traiter les affections cutanées chroniques, notamment le psoriasis, en modulant la réponse immunitaire afin de réduire les symptômes et de prévenir les poussées. En ophtalmologie, les biosimilaires aident à gérer des maladies telles que la dégénérescence maculaire liée à l'âge, en fournissant des traitements essentiels qui préservent la vision et préviennent les déficiences visuelles graves.
En oncologie, les biosimilaires jouent un rôle essentiel en augmentant la disponibilité des anticorps monoclonaux utilisés pour cibler et neutraliser les cellules cancéreuses. Cette application est essentielle pour améliorer les résultats des patients dans le traitement de divers cancers, notamment le cancer du sein, le cancer colorectal et le cancer du poumon non à petites cellules.
Processus d'approbation et sécurité des biosimilaires
En Suisse, l'approbation des biosimilaires est gérée par l'Institut suisse des produits thérapeutiques (Swissmedic), qui a élaboré ses propres normes rigoureuses qui, tout en s'inspirant des pratiques mondiales, sont adaptées aux besoins spécifiques du pays en matière de soins de santé et de normes de sécurité.
Le processus d'approbation d'un biosimilaire en Suisse commence par une évaluation analytique exhaustive. Cette phase initiale implique une comparaison détaillée des caractéristiques moléculaires et biologiques du biosimilaire avec celles du produit biologique de référence. L'évaluation se concentre sur une série d'attributs, notamment les séquences d'acides aminés, les modifications post-traductionnelles telles que les schémas de glycosylation et les structures d'ordre supérieur.
Après l'évaluation analytique, le biosimilaire est soumis à des essais précliniques pour évaluer sa toxicité, sa pharmacocinétique (comment le médicament est absorbé, distribué, métabolisé et excrété dans l'organisme) et sa pharmacodynamie (les effets biologiques du médicament sur l'organisme). Ces études sont essentielles pour identifier tout impact biologique potentiel avant de procéder aux essais cliniques.
Les essais cliniques pour les biosimilaires en Suisse sont complets et couvrent la pharmacocinétique et la pharmacodynamie, ainsi que l'immunogénicité et les profils de sécurité. Ces essais sont conçus pour confirmer qu'il n'y a pas de différences cliniquement significatives entre le biosimilaire et son produit de référence en ce qui concerne la sécurité, l'efficacité et la réponse immunogène.
En outre, Swissmedic impose une surveillance continue après la mise sur le marché afin de contrôler la sécurité et l'efficacité à long terme des biosimilaires. Cette surveillance permet de détecter tout effet indésirable qui n'aurait pas été mis en évidence par les études préalables à l'autorisation et de s'assurer que tout risque potentiel est géré rapidement et efficacement.
L'avenir des biosimilaires avec iQone Healthcare
Le marché des biosimilaires devrait connaître une croissance significative, en raison de l'expiration des brevets de plusieurs produits biologiques de premier plan au cours des prochaines années. Cela ouvrira la voie à l'arrivée de nouveaux biosimilaires sur le marché, ce qui renforcera la concurrence et fera baisser le coût des traitements biologiques.
En outre, les progrès de la biotechnologie améliorent l'efficacité et la précision du développement des biosimilaires, ce qui permet d'obtenir des produits encore plus robustes et plus efficaces. Cela pourrait potentiellement élargir le champ d'application des biosimilaires au-delà de la simple reproduction des thérapies biologiques existantes, et ouvrir des opportunités pour de nouveaux traitements.
La sensibilisation et l'éducation accrues des professionnels de la santé et des patients à l'égard des biosimilaires joueront également un rôle important dans l'avenir de ce marché. À mesure qu'un plus grand nombre de parties prenantes se familiariseront avec ces produits et leurs avantages potentiels, nous pouvons nous attendre à une plus grande acceptation et adoption des biosimilaires dans les systèmes de santé du monde entier.
Chez iQone Healthcare Switzerland, nous sommes animés par la conviction que l'innovation, le travail et l'effort ont le pouvoir d'améliorer la vie de ceux qui nous entourent. Sous la bannière « iQone for you », nous nous concentrons sur la distribution de biosimilaires de haute qualité et de médicaments innovants spécifiquement adaptés aux besoins du marché suisse. En tant qu'entreprise pharmaceutique indépendante spécialisée, notre mission principale est de veiller à ce que les avancées thérapeutiques telles que les biosimilaires et les médicaments révolutionnaires atteignent les patients qui en ont besoin, au moment où ils en ont besoin.
Avec l'un des portefeuilles de biosimilaires les plus complets de Suisse, nous nous diversifions continuellement avec de nouveaux médicaments innovants, chacun conçu pour traiter un éventail de maladies. Notre objectif est d'offrir une gamme distincte et holistique d'options thérapeutiques, traitant une variété d'états pathologiques et démontrant notre engagement à améliorer les soins et les résultats pour les patients tout en soulignant notre soutien aux professionnels de la santé et au système de santé suisse.
Pour en savoir plus sur notre portefeuille de produits biosimilaires et sur les nouveaux développements de produits, veuillez consulter notre site web et n'hésitez pas à nous contacter pour de plus amples informations.
Biosimilars FAQs
Quelle est la différence entre un biosimilaire et un original ?
Un produit biologique original est un produit complexe généré par des processus biotechnologiques à l'intérieur de cellules vivantes. Un biosimilaire est similaire au produit biologique original mais n'apparaît sur le marché que lorsque le produit de référence n'est plus protégé par un brevet. Un biosimilaire est « similaire » à l'original en termes d'efficacité, de sécurité et de qualité, ainsi qu'au sens clinique ; de très légères variations peuvent toutefois survenir, car les biosimilaires sont produits par des systèmes vivants (cellules).
Les biosimilaires sont-ils identiques aux produits biologiques originaux ?
Les biosimilaires ne sont pas identiques aux produits biologiques originaux en raison des complexités inhérentes et des variations naturelles du processus de production biologique. Chaque produit biologique, y compris les biosimilaires, est produit dans des cellules vivantes, ce qui peut entraîner de légères variations dans les molécules biologiques. Les biosimilaires sont similaires aux produits biologiques originaux.
Quelle est l'efficacité d'un biosimilaire par rapport au produit de référence ?
Ils sont aussi efficaces l'un que l'autre, comme l'ont montré des essais cliniques répétés et comme le certifie Swissmedic. En raison de leur origine biologique, les biosimilaires peuvent varier légèrement d'une production à l'autre, mais ces variations restent dans des limites très précises et n'influencent en rien la sécurité, l'efficacité et la qualité des produits.
Les biosimilaires sont-ils sûrs ?
Oui, les biosimilaires sont aussi bien tolérés que les produits de référence.
Ils sont soumis à des tests rigoureux et doivent répondre à des normes réglementaires strictes en matière de sécurité, d'efficacité et de qualité, comme les médicaments biologiques originaux, avant d'être approuvés.
Y a-t-il une différence de prix entre un biosimilaire et l'original ? Le biosimilaire est-il remboursé par les assurances ?
Selon l'Office fédéral de la santé publique (OFSP), les biosimilaires doivent coûter au moins 20 à 35 % de moins que leurs produits de référence au moment de leur mise sur le marché (avec quelques exceptions). Les biosimilaires sont remboursés par les assurances en fonction de la situation individuelle.
Où puis-je trouver des informations supplémentaires et détaillées sur vos produits biosimilaires et leur utilisation ?
Pour plus d'informations sur nos produits, n'hésitez pas à nous contacter ou à visiter le site Internet de Swissmedic.
Click here to see English version
Klicken Sie hier, um die deutsche Version zu sehen

